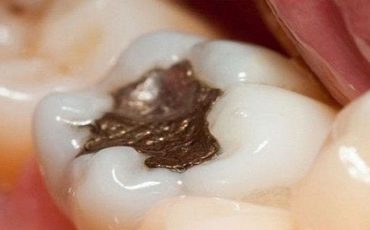
La présence de différents métaux en bouche (par exemple amalgame, or et mercure, ou acier inoxydable et mercure) entraîne une action galvanique , c’est à dire un courant électrique, lequel a pour conséquence des niveaux beaucoup plus élevés de dégagement de vapeur de mercure dans les tissus oraux. (1-11.30) Selon de nombreuses études, la quantité de mercure déchargée dans la salive s’est avérée être environ 1,5 à 1,9 microgrammes par litre pour chaque obturation additionnel d’amalgame (26). La quantité de mercure libérée par un bridge en alliage d’or au-dessus d’amalgame sur une période de 10 ans a été évaluée approximativement à 101 milligrams(mg)(60% du total) ou 30 microgrammes (ug) par jours (7), et d’autres études ont trouvé des résultats semblables (4). Les niveaux moyens de mercure dans les tissus gingivaux près des obturations d’amalgame sont environ 200 ppm par minute, et sont le résultat de l’écoulement du mercure dans la membrane muqueuse en raison des courants galvaniques avec la portion de membrane muqueuse. Celle ci jouant le rôle de cathode et le métal de l’amalgame servant d’anode(1-4). Les concentrations de vapeur de mercure dans la muqueuse orale dans une population de patients avec 6 obturations ou plus d’amalgame posés pendant la chirurgie dentaire atteignaient 20 fois le niveau de contrôles (14), et le niveaux à l’extrémité des racines étaient de 41 ppm(5). L’amalgame libère également les quantités significatives d’argent, d’étain, et de cuivre qui ont également des effets toxiques, avec par exemple des composés d’étain organiques formés dans le corps l’étain étant bien plus neurotoxique que le mercure inorganique.
Le mercure et d’autres métaux s’accumulent dans la cavité buccale dans les fibroblastes, macrophages, et cellules géantes multinuclées des tissus connectifs, dans des murs de vaisseau sanguin, le long des fibres des gaines des nerfs, dans les membranes basales des épithélium muqueux, dans les fibres striées des muscle, le long des faisceaux de collagène et dans les tissus élastiques, dans les acini des glandes salivaires, et dans les racines de dents et l’os des maxillaires (5,11). Du mercure comme celui trouvé dans les tatouages généralement formés d’amalgame se déplace dans d’autres parties du corps avec le temps dans des quantités non-négligeables et plus rapidement que les autres métaux. Les macrophages enlèvent le mercure par la phagocytose et le mercure se déplace à d’autres parties du corps par le sang et le long des nerfs (5). La plupart des dentistes ne se rendent pas compte de la source principale des tatouages d’amalgame : le galvanisme orale, lorsque les courants électriques provoqués par les métaux mélangés dans la bouche transportent les métaux dans les gencives et la muqueuse orale, s’accumulant à la base des dents comportant de grandes obturations ou au niveau de couronnes métalliques sur un moignon d’amalgame (1-5). Il est démontré que de tels métaux peuvent causer les lésions locales et systémiques et des effets sur la santé, qui guérissent habituellement après éviction du tatouages d’amalgame par chirurgie (5fghi). Les niveaux élevés de mercure accumulé également sont dispersés à d’autres parties du corps.
Les obturations d’amalgame produisent les courants électriques qui augmentent le dégagement des vapeurs de mercure et peuvent avoir autre effets (1-14,38) nocifs. Ces courants sont mesurés en microampères , dont certains atteignent plus de 5 micro-ampères. Dans une clinique ou l’on avait une expérience importante sur la façon de traiter les problèmes de galvanisme oral, on a constaté que les courants plus de 5 microampères posent habituellement des problèmes significatifs de santé tels que des maux de tête, des migraines, la nausée, etc. qui ont été éliminé quand les obturations d’amalgame étaient remplacé (20). Le système nerveux central produits des signaux dans la gamme des nanos ampères, qui est 1000 fois moins qu’un (38) micro amp. Les métaux offrent également des possibilités électriques qui peuvent être mesurées en millivolts (mV). Une étude clinique a déterminé que les différences de potentiels électriques de plus de 50mv étaient pathologique(9b), entraînant le phénomène de galvanisme, la leucoplasie, le lichen plan oral, ou les réactions toxiques ou allergiques aux restaurations (9a, 1-8). Chez la plupart des sujets avec des obturations d’amalgame, les différences de potentiel dépassant la valeur de 50mv sont présentes entre les restaurations(9a), avec des potentiels s’étendant du – 417mv à +150mv sachant que les potentiels négatifs peuvent être plus pathologiques que les positifs. Le potentiel moyen pour des couronnes et des ponts en métal était de 154mv et pour des brackets de bagues de 71 mV(9a).
Les obturations ou les couronnes négativement chargés transportent des électrons dans la cavité buccale puisque la salive est un bon électrolyte et cause un dégagement de vapeur de mercure plus important
(11,1-6). Les patients atteints de pathologies auto-immunes aussi bien que les patient atteint de MS, d’épilepsie, ou de dépression, etc. sont souvent sujet à un courant négatif élevé au niveau des restaurations (11). Le protocole dentaire complet de Hugins (TDR-Total Dental Revision) affirme que les dents comportant la charge négative la plus élevée sont à remplacer en premier (11). D’autres protocoles pour retirer les amalgame sont fournis par des Associations Dentaires Internationales comme IAOMT(45) et des association de patients contre le mercure comme la DAMS(46). Pour ces raisons il est important qu’aucun travail dentaire en or ne soit placé dans la bouche jusqu’à au moins 6 mois après remplacement.
Quelques études ont également trouvé que des personnes présentant une exposition chronique au champs électromagnétique (EMF) pouvaient présenter des niveaux plus élevés d’exposition au mercure et dans les excrétion(33c, 38). De tels champs sont connus pour induire des courants électriques dans les métaux ce qui augmenteraient les effets du galvanisme. L’EMF est également documenté chez les études chez l’animal et l’homme pour causer un flux cellulaire de calcium et pour affecter l’homéostasie du calcium (39.40), ce qui dans ces études chez animal et l’humain (40,41) peut être un facteur dans la réduction de niveaux de Mélatonine provoqués par exposition d’EMF Dans les études sur des poussins, ceci a eu des effets nuisibles significatifs sur la viabilité des embryons et des poussins. La Mélatonine est connu pour être protectrice de l’activité du mercure et des radicaux libres, aussi bien que régulatrice des cycles de rythme circadien et du cycle de sommeil. L’exposition d’EMF abaisse la production de Mélatonine et perturbe le cycle du sommeil (41). Puisque le mercure est connu pour avoir certains de ces mêmes effets, l’exposition d’EMF augmente les effets similaires du mercure relargué par l’amalgame, mais le rôle relatif des mécanismes de causalité n’est pas encore clairement établit chez l’homme. L’exposition professionnelle à des niveaux plus élevés d’EMF se sont également avérées dans beaucoup d’études pour avoir comme conséquence un risque beaucoup plus élevé des conditions neurologiques dégénératives chroniques telles que l’ALS(42), la maladie d’Alzheimer (43,33c), aussi bien que la leucémie et le Cancer (44,47,33c). L’analyse mise en commun de 3.247 cas de leucémie d’enfance en Europe, l’Amérique du Nord et Nouvelle-Zélande a édité le plus grand taux l’année dernière trouvé de leucémie dans ceux avec des expositions élevées d’EMF, plus de 4 microgauss(47a). Les études au Royaume-Uni ont constaté qu’1 enfant britannique sur 200 est exposés aux niveaux élevés du rayonnement électromagnétique dans la maison et que ceci pourrait doubler leur risque de leucémie (47). Puisque les EMF cause une exposition accrue de mercure dans ceux avec l’amalgame, et que le mercure est également connu pour causer ces conditions, il conviendrait d’éclairci l’importance relative de ces différents facteurs par rapport au relargage du mercure puisque jusqu’à présent les études n’étaient pas dirigées vers une évaluation des niveaux de mercure ou le nombre de obturations d’amalgame des sujets.
Les études ont prouvé que le mercure dans les gencives, qui provient d’obturation a retro au niveau des apex des racines ou des dents au niveau desquelles l’amalgame a tatoué la gencive peut être la cause d inflammation chronique, en plus de pouvoir migrer dans d’autres parties du corps (5,10,15). Le mercure, l’étain, et l’argent des obturations d’amalgame peuvent être vus dans les tissus comme des tatouages à l’amalgame qui se sont avérés s’accumuler dans la muqueuse orale comme granules le long des faisceaux de collagène, des vaisseaux sanguins, des gaines des nerf, des fibres élastiques, des membranes, des fibres striées de muscle, et des acini des glandes(5,10) salivaires mineures. Des granules sombres sont également présentes intracellulairement dans des macrophages, des cellules géantes multinuclées, des cellules endothéliales, et des fibroblastes. Il y a dans la plupart des cas une réponse inflammatoire chronique ou la réaction macrophagique avec les métaux (5,30), habituellement sous forme de granulome comportant des cellules géantes multinuclées et des cellules de Langhans. Les niveaux de mercure sont souvent plus de 1000 ppm par minute près d’un coiffage d’or sur une oburation à l’amalgame dû à des courants plus élevés quand l’or est en contact avec l’amalgame (8,9c,11,12,13). Des niveaux semblables aussi élevés que 5000 ppm par minute ont été trouvés par les chirurgiens dentistes allemands dans l’os de mâchoire sous de grandes obturations ou couronnes en or(37). Ces niveaux sont parmi les niveaux les plus élevés jamais mesurés dans les tissus de la matière organique, excédant les niveaux les plus élevés trouvés chez des ouvriers chroniquement exposés au « chloralkali », ceux qui sont morts dans Minamata, ou les animaux qui sont morts d’empoisonnement au mercure (29). Le niveau d’alerte de la FDA pour le taux de mercure dans le poissons ou la nourriture est de 1 ppm par minute. Des avertissements sont donnés à 0,5 ppm par minute, et le niveau de critère de santé de l’EPA est de 0,3 ppm par minute. Certains des effets oraux du mercure qui ont été documentés dans des études incluent la gingivites, les lésions orales, la douleur et le malaise, la bouche brûlante, le goût métallique persistant, la réponse inflammatoire chronique, la leucoplasie, le lichen plan buccal, la réponse auto-immune, le cancer oral, la névralgie du trigéminé, les réactions allergique, etc.(4,5,9a,11,15,19,22,23,25,26,30-35)
Le mélange des divers composant des amalgames s’est également avéré un facteur important dans des émissions de vapeur de mercure. Le niveau du mercure et du cuivre libérés de l’amalgame à taux de cuivre élevé n’est pas moins de 50 fois plus important que celui des amalgames à bas taux de cuivre (16). Les études ont uniformément trouvé que les amalgames à taux élevé en cuivre (gamma-2) entraîneraient un plus grand dégagement de vapeur de mercure que les amalgames d’argent conventionnels (17-21). Tandis que les amalgames non-gamma 2 qui sont reconnu pour être moins corrosifs et moins enclins aux ruptures marginales que les amalgames d’argent conventionnels, se sont avérés instables sous l’effet de différents mécanisme une fois soumis à au port en bouche, au polissage, à la mastication, et au brossage : ils présentaient sur la surface de l’Amalgame des gouttelettes de mercure (3,23,24). Ainsi ces amalgames non-gamma 2 “moderne”, se sont avérés être un facteur de dégagement beaucoup plus élevé de vapeur de mercure. Les études récentes ont conclu qu’en raison des niveaux élevés de dégagement de mercure des amalgames modernes, des niveaux de mercure plus élevés que ceux toléré par les directives de santé du gouvernement sont transférés aux poumons, au sang, au cerveau, au SNC, aux reins, au foie, etc. d’un grand nombre de personnes qui présentent des obturations à l’amalgame et des effets sur le système immunitaire, ainsi que des effets neurologiques et sur le système endocrinien peuvent parfois survenir. (25,26,27,28).
Sources : http://www.eatingalive.com/windham/windhamB.htm
Auteur : Facts about Mercury and Dental Amalgam
(With Medical Study References)
Bernard Windham, Editor—Chemical Engineer
12164 Whitehouse Road, Tallahassee, FL 32311
850-878-9024
References
(1) N. Nogi, “Electric current around dental metals as a factor producing allergic metal ions in the oral cavity”, Nippon Hifuka Gakkai Zasshi, 1989, 99(12):1243-54.
(2) A.J. Certosimo, et al., National Naval Dental Center, “Oral Electricity”, Gen Dent, 1996, 44(4):324-6; & B.M. Owens, et al., “Localized galvanic shock after insertion of an amalgam restoration”, Compenium, 1993, 14(10):1302,1304,1306-7.
(3) R.H. Ogletree, et al., School of Materials Science, GIT, Atlanta, “Effect of mercury on corrosion of etaÆ Cu-Sn phase in dental amalgams”, Dent Mater, 1995, 11(5):332-6.
(4) R.D. Meyer, et al., “Intraoral galvanic corrosion”, Prosthet Dent, 1993, 69(2):141-3; & J Pleva, J Orthomol Psych, Vol. 12, No.3, 1983; & J. of Orthomol. Medicine, 1989, 4:141-148; & “Mercury- A Public Health Hazard”, Reviews on Environmental Health, 1994, 10:1-27.
(5) A. Buchner, et al., “Amalgam tattoo of the oral mucosa: a clinicopatholigic study of 268 cases”, Surg Oral Med Oral Pathol, 1980, 49(2):139-47; & M. Forsell, et al., “Mercury content in amalgam tattoos of human oral mucosa and its relation to local tissue reactions”, Euro J Oral Sci, 1998, 106(1):582-7; & J.D. Harrison, et al., “Amalgam tattoos: light and microscopy and electron-probe micro-analysis; & T. Kanzaki, et al., “Electron microscopic X-ray microanalysis of metals deposited in oral mucosa”, J Dermatol, 1992, 19(8):487-92; & K. Nilner, et al., “In vitro testing of dental materials by means of macrophage cultures”, J Biomed Mater Res, 1986, 20(8):1125-38.
(6) M.D. Rose, et al., Eastman Dental Institute, “The tarnished history of a posteria restoration”, Br Dent J, 1998, 185(9):436; & Johansson E, Liliefors T, “Heavy elements in root tips from teeth with amalgam fillings”, Department of Radiation Sciences, Division of Physical Biology, Box 535, 751 21 Uppsala, Sweden.
(7) Matts Hanson, “Amalgam hazards in your teeth”, Dept of Zoophysiology, University of Lund, Sweden, J. Orthomolecular Psychiatry, Vo12, No 3, Sept 1983, 194-201; & Lorscheider & Vimy, “Mercury exposure from silver fillings”, The Lancet, Vol 337, May 4, 1991; & (c) Jackson GH, Quantitative analysis of Hg, Ag, Sn, Cu, Zn and trace elements in amalgam removed from an abutment tooth underneath a gold alloy bridge that had been in vivo for nine plus years,
www.ibiblio.org/amalgam/.
(8) T. Till, et al., “Mercury release from amalgam fillings and oral dysbacteriosis as a cause of resorption phenomena”, Zahnarztl Welt/Reform (ZWR), 1978, 87:1130-1134; & S. Olsson, et al., “Release of elements due to electrochemical corrosion of dental amalgam”, J of Dental Research, 1994, 73:33-43.
(9) K. Arvidson, “Corrosion studies of dental gold alloy in contact with amalgam”, Swed. Dent. J., 68:135-139, 1984; & Skinner EW, The Science of Dental Materials, 4th Ed. revised, W.B. Saunders Co., Philadelphia, p284-285, 1957; & Momoi Y, et al., “Measurement of galvanic current and electrical potential in extracted human teeth”, J Dent Res, 65(12):1441-1444; & Holland RI, “Galvanic currents between gold and amalgam”, Scand J Dent Res, 1980, 88:269-72; & Wang Chen CP, Greener EH, “A galvanic study of different amalgams”, Journal of Oral Rehabilitation, 1977, 4:23-7; & Lemons JE, et al., “Interoral corrosion resulting from coupling dental implants and restorative metallic systems”, Implant Dent, 1992, 1(2):107-112.
(10) B.M Eley, S.W. Cox, “Influence of levels of selenium on renal pathology from mercury released by experimental amalgam tattoos”, Biomaterials, 1988, 9(4):339-44; & “Effects of particle size and amount of implanted amalgam tattoos’’, Biomaterials, 1987, 8(5):401-3; & “The release, tissue distribution and excretion of mercury from experimental amalgam tattoos”, Br J Exp Pathol, 1986, 67(6):925-35; & Biomaterials, 1983, 4(2):73-80.
(11) Hal Huggins, Its All in Your Head, 1997; & Proceedings: ICBM Conf. Colorado, 1988; & S. Ziff, Dentistry without Mercury, 8th Edition, 1996, Bio-Probe, Inc., ISBN 0-941011- 04-6.
(12) H. Freden, et al., “Mercury in gingival tissues adjacent to amalgam fillings”, Odontal Revy, 1974, 25(2):207-210; & H Reden, Odontal Revy, 1971, (25):207-210.
(13) C. Malmstrom, M. Hansson, M. Nylander, Conference on Trace Elements in Health and Disease, Stockholm, May 25, 1992.
(14) B. Willershausen, et al., “Mercury in the mouth mucosa of patients with amalgam fillings”, Dtsch Med Wochenschr, 1992, 117:46, 1743-7.
(15) V. Nadarajah, et al., “Localized cellular inflammatory response to subcutaneously implanted dental mercury”, J Toxicol Environ Health, Oct 11, 49(2):113-25.
(16) D. Brune, et al., Scand J Dent Res, 1983, 19:66-71; & Sci Tot Envir, 1985, 44:…; & “Metal release from dental materials”, Biomaterials, 1986, 7:163-175.
(17) C. Toomvali, “Studies of mercury vapor emission from different dental amalgam alloys”, LIU-IFM-Kemi-EX 150, 1988; & D.B. Boyer, “Mercury vaporization from corroded dental amalgam”, Dental Materials, 1988, 4:89-93.
(18) A. Berglund, “A study of the release of mercury vapor from different types of amalgam alloys”, J Dent Res, 1993, 72:939-946.
(19) H. Lichtenberg, “Mercury vapor in the oral cavity in relation to the number of amalgam fillings and chronic mercury poisoning”, Journal of Orthomolecular Medicine, 1996, 11:2, 87-94.
(20) V. Psarras, et al., “Effect of selenium on mercury vapour released from dental amalgams”, Swed Dent J, 1994, 18:15-2.
(21) L.E. Moberg, “Long term corrosion studies of amalgams and casting alloys in contact”, Acta Odontal Scand, 1985, 43:163-177; & L.E. Moberg, “Corrosion products from dental alloys”, Published Dissertation, Stockholm, 1985.
(22) T. Weaver, et al., “An amalgam tattoo causing local and systemic disease”, Oral Surg Oral Med Oral Pathol, 1987, 63(1):137-40; & J.P. McGinnis, et al., “Amalgam tattoo: use of energy dispersive X-ray analysis as an aid in diagnosis”, J Amer Dent Assoc, 1985, 110(1):52-4.
(23) J Pleva, J Orthomol Psych, Vol 12, No.3, 1983; & J Orthomol Medicine, 1989, 4:141-148.
(24) P.E. Schneider, et al., “Mercury release from Dispersalloy amalgam”, IADR Abstracts, #630, 1982; & N. Sarkar, “Amalgamation reaction of Dispersalloy re-examined”, IADR Abstracts #217, 1991; & N.K. Sarkar, et al., IADR Abstracts # 895, 1976; & R.S. Mateer, et al., IADR Abstracts #240, 1977; & N.K. Sarkar, et al., IADR Abstracts, #358, 1978; & N.W. Rupp, et al., IADR Abstracts # 356, 1979.
(25) H.J. Lichtenberg, “Elimination of symptoms by removal of dental amalgam from mercury poisoned patients”, J Orthomol Med, 8:145-148, 1993; & “Symptoms before and after removal of amalgam”, J of Orth Med, 1996, 11(4):195-.
(26) Dr. P. Kraub & M. Deyhle, Universitat Tubingen- Institut fur Organische Chemie, “Field Study on the Mercury Content of Saliva”, 1997,
http://www.uni-tuebingen.de/KRAUSS/amalgam.html (20,000 people tested for mercury level in saliva and health status/symptoms compiled).
(27) Public Statement: BBC Panorama Program on Dental Amalgam: “The Poison in Your Mouth”, June 1994, by World Health Organization Scientific Panel Members: Dr. Lars Friburg- chairman; Dr. Fritz Lorscheider, Professor of Medical Physiology, Univ. of Calgary; Dr. Murray Vimy, Professor of Oral Biology and Dental Medicine, Univ. of Calgary Medical School; Dr. Vasken Aposhian, Dept. Head, Molecular and Cellular Biology, Univ. of Arizona; Dr. David Eggleston, Univ. of California, researcher on mercury in the brain; Dr. Boyd Haley, Univ. of
Kentucky, researcher on mercury in the brain and Alzheimer’s Disease; Dr. Gustav Drasch, Univ. of Munich, researcher on mercury in brains of dead infants and fetuses; Dr. D. Echeverria, Neuro-Toxicologist, researcher on reproductive problems and birth defects in dental workers, Batelle Center for Public Health Research, Seattle, Wash.
(28) B. Windham, Annotated Bibliography: Exposure and Health Effects Related to Mercury/ Amalgam and Clinical Results of Amalgam Replacement, 2000 (over 800 medical study references and 60,000 clinical cases followed by doctors) www.home.earthlink.net/~berniew1/amalg6.html
(29) C.F. Face mire, et al., “Reproductive impairment in the Florida panther”, Health Perspect, 1995, 103(Supp4):79-86.
(30) Forsell M, Larsson B, et al., “Reactions of the oral mucosa related to silver amalgam: a review”, Eur J Oral Sci, 1998 Feb, 106(1):582-7; & Fisher, et al., J Oral Rehab, 1984, 11:399- 405; & Goldschmidt, et al., J. Perio. Res., 1976, 11:108-115; & Zander, JADA, 1957, 55:11-15; & App, J Prosth Dent, 1961, 11:522-532; & Trott and Sherkat, J CDA, 1964, 30:766-770; & Sanches Sotres, et al., J. Periodo., 1969, l40:543-546; & Turgeon, et al., J CDA, 1972, 37:255-256; & Trivedi and Talim, J. Prosth. Dentistry, 1973, 29:73-81.
(31) E.R. Smart, et al., “Resolution of lichen planus following removal of amalgam restorations”, Br Dent J, 1995, 178(3):108-112 (12 cases); & H. Markow, “Regression from urticaria following dental filling removal”, New York State J Med, 1943, 1648-1652; & G. Sasaki, et al., “Three cases of oral lichenosis caused by metallic fillings”, J. Dermatol, 23 Dec, 1996, 12:890-892; & J. Bratel, et al., “Effect of replacement of dental amalgam on OLR”, Journal of Dentistry, 1996, 24(1-2):41-45 (161 cases).
(32) A. Skoglund, Scand J Dent Res, 1994, 102(4):216-222 and 1991, 99(4):320-9 (40 cases); & P.O. Ostman, et al., “Clinical and histologic changes after removal of amalgams”, Oral Surgery, Oral Medicine, and Endodontics, 1996, 81(4):459-465; & S.H. Ibbotson, et al., “The relevance of amalgam replacement on oral lichenoid reactions”, British Journal of Dermatology, 1996, 134(3):420-3 (270 cases).
(33) Y. Omura, et al., Heart Disease Research Foundation, NY, NY, “Role of mercury in resistant infections and recovery after Hg detox with cilantro”, Acupuncture & Electro-Therapeutics Research, 1995, 20(3):195-229; & “Mercury exposure from silver fillings”, Acupuncture & Electrotherapy Res, 1996, 133-.
(34) R.L. Siblerud, “Relationship between dental amalgam and health”, Toxic Substances Journal, 1990b, 10:425-444; & “Effects on health following removal of dental amalgams”, J Orthomolecular Med, 5(2): 95-106; & “Relationship between amalgam fillings and oral cavity health”, Ann Dent, 1990, 49(2):6-10 (86 cured).
(35) Redhe O, Sick From Amalgam R-Dental Ab, Frejavagen 33, S-79133 Falun, Sweden (in Swedish) (100 cases).
(36) M. Daunderer, Handbuch der Amalgamvergiftung, Ecomed Verlag, Landsberg 1998, ISBN 3-609-71750-5 (in German).
(37) Schiwara, H.-W. (Medical Laboratory) Arzte fur Laboratoriumsmedizen, D-28357 Bremen; & Heavy Metal Bulletin, 1999, No. 1, p28.
(38) F. Schmidt, et al., “Mercury in urine of employees exposed to magnetic fields”, Tidsskr Nor Laegeforen, 1997, 117(2):199-202; & Sheppard AR, Eisenbud M, “Biological effects of electric and magnetic fields of extremely low frequency”, New York University Press, 1977; & Ortendahl T W, Hogstedt P, Holland RP, “Mercury vapor release from dental amalgam in vitro caused by magnetic fields generated by CRT’s”, Swed Dent J, 1991, p 31, Abstract.
(39) Aldinucci C, Palmi M, Sgaragli G, Benocci A, Meini A, Pessina F, Pessina GP, “The effect of pulsed electromagnetic fields on the physiologic behaviour of a human astrocytoma cell line”, Biochim Biophys Acta, 2000, 11;1499(1-2):101-108.
(40) Pablos MI, Agapito MT, Gutierrez-Baraja R, Reiter RJ, Recio JM, “Effect of calcium on melatonin secretion in chick pineal gland”, I. Neurosci Lett, 1996 Oct18, 217(2-3):161-4; & Nikaido SS, Takahashi JS, “Calcium modulates circadian variation in cAMP-stimulated melatonin in chick pineal cells”, Brain Res, 1996, 15;716(1-2):1-10; & Youbicier-Simo BJ, Boudard F, Cabaner C, Bastide M, “Biological effects of continuous exposure of embryos and young chickens to electromagnetic fields emitted by video display units”, Bioelectromagnetics, 1997, 18(7):514-23.
(41) Juutilainen J, Stevens RG, et al., “Nocturnal 6-hydroxymelatonin sulfate excretion in female workers exposed to magnetic fields”, J Pineal Res, 2000, 28(2):97-104; & Akerstedt T, Arnetz B, Ficca G, Paulsson LE, Kallner A, “A 50-Hz electromagnetic field impairs sleep”, J Sleep Res, 1999 Mar, 8(1):77-81.
(42) Savitz DA, Checkoway H, Loomis DP, “Magnetic field exposure and neurodegenerative disease mortality among electric utility workers”, Epidemiology, 1998 Jul, 9(4):398-404; & Savitz DA, Loomis DP, Tse CK, “Electrical occupations and neurodegenerative disease: analysis of U.S. mortality data”, Arch Environ Health, 1998 Jan-Feb, 53(1):71-4; & Johansen C, Olsen JH, “Mortality from amyotrophic lateral sclerosis, other chronic disorders, and electric shocks among utility workers”, Am J Epidemiol, 1998 Aug 15, 148(4):362-8; & Davanipour Z, Sobel E, Bowman JD, Qian Z, Will AD, “Amyotrophic lateral sclerosis and occupational exposure to electromagnetic fields”, Bioelectromagnetics, 1997, 18(1):28-35.
(43) Sobel E, Dunn M, Davanipour Z, Qian Z, Chui HC, “Elevated risk of Alzheimer’s disease among workers with likely electromagnetic field exposure”, Neurology, 1996, 47(6):1477-81; & Sobel E, Davanipour Z, “Electromagnetic field exposure may cause increased production of amyloid beta and eventually lead to Alzheimer’s disease”, Neurology, 1996 Dec, 47(6):1594-600; & Sobel E, Davanipour Z, Sulkava R, Erkinjuntti T, Wikstrom J, et al., “Occupations with exposure to electromagnetic fields: a possible risk factor for Alzheimer’s disease”, Am J Epidemiol, 1995 Sep 1, 142(5):515-24.
(44) London SJ, Bowman JD, Sobel E, Thomas DC, Garabrant DH, Pearce N, Bernstein L, Peters JM, “Exposure to magnetic fields among electrical workers in relation to leukemia risk in Los Angeles County”, Am J Ind Med, 1994 Jul, 26(1):47-60; & Caplan LS, Schoenfeld ER, O’Leary ES, Leske MC, “Breast cancer and electromagnetic fields–a review”, Ann Epidemiol 2000 Jan, 10(1):31-44.
(45) International Academy of Oral Medicine and Toxicology, “A Scientific Response to the American Dental Association Special Report and Statement of Confidence in Dental Amalgam”, IAOMT, POB 608531, Orlando, 32860-8531, http://emporium.turnpike.net/P/PDHA/mercury/asr.htm; & IAOMT, Protocol for Mercury/Silver Filling Removal, http://emporium.turnpike.net/P/PDHA/mercury/iaomt.htm.
(46) Amalgam/mercury poisoned patients’ organizations, DAMS: Assoc. of Dental Mercury Patients-U.S., http://www.amalgam.org.