Le succès à long terme des thérapies endodontiques repose sur un remplissage complet après obturation canalaire 12 . La microfuite est l’une des causes importantes de défaillance endodontique, qui se produit en raison de mauvais contacts entre la gutta-percha et le scellant, le scellant et la dentine, ou à travers des vides à l’intérieur du scellant 16 , 26 . En général, les bactéries buccales pourraient contaminer toute la longueur du canal radiculaire dans les 30 jours suivant l’obturation 16 , tandis que les endotoxines d’ Actinobacillus actinomycetemcomitans pourraient être observées dans les canaux radiculaires obturés dans les 20 jours 26 .
En raison de la complexité des systèmes de canaux radiculaires, les tissus pulpaires et les débris inorganiques restent dans les zones où les instruments et les solutions d’irrigation ne sont pas facilement accessibles après les traitements canalaires. Ainsi, les micro-organismes qui survivent dans le canal radiculaire se développeront et se répandront ensuite dans les zones périradiculaires entre le scellant et la dentine 27 . Les restaurations coronales permanentes fournissent également des joints aussi importants que le joint apical après le remplissage des canaux radiculaires 3 . En cas de scellement coronaire insuffisant ou lorsque le canal radiculaire reste ouvert (par exemple, lorsque le scellement est retardé pour les obturations permanentes, les obturations cassées ou la formation de caries secondaires, etc.), les bactéries buccales accèdent au foramen apical 28 .
Il n’est pas facile d’obtenir un remplissage complet avec les matériaux actuels de remplissage des racines utilisés dans la clinique, en raison des changements dimensionnels et du manque d’adhérence de la gutta-percha, ce qui est également la raison d’utiliser des scellants endodontiques en combinaison avec de la gutta-percha . Ainsi, l’adaptabilité d’un scellant à la dentine est le principal facteur influençant les microfuites et la réinfection du canal radiculaire 19. De nombreux scellants endodontiques sont utilisés dans la pratique clinique, y compris les scellants à base de silicate de calcium récemment introduits. Le scellant EndoSequence BC (Brasseler USA, Savannah, Georgia, USA; également appelé iRoot SP; (Innovative. BioCeramix Inc, Vancover, Brtish Columbia, Canada)) a été présenté comme un biomatériau prémélangé et injectable idéal dans la clinique, présentant un excellent radio-opaque , à retrait nul, insoluble et hydrophile (en utilisant l’humidité des tubules dentinaires pour initier et achever sa réaction de prise) 9 .
L’adaptation d’un scellant à la dentine a généralement été évaluée par stéréomicroscopie, microscopie laser confocale, microscopie électronique à balayage (MEB), tests de fuite et imagerie numérique 13 , 20 , 25 . Comparée à d’autres méthodes d’évaluation bidimensionnelles (2D), chronophages et destructives, la tomographie micro-informatique (micro-CT) est un type de modalité d’imagerie avancée utilisée pour numériser les racines remplies et les reconstruire en trois dimensions (3D) pour l’évaluation de l’adaptation du mastic aux parois du canal radiculaire 13. À notre connaissance, cependant, aucune recherche n’a été effectuée sur la microporosité 3D en utilisant la micro-CT pour évaluer la capacité d’étanchéité du scellant BC dans tout le système de canal radiculaire et sa zone de dentine circonférentielle. De plus, il n’y a pas encore d’étude utilisant SEM et micro-CT à cet effet.
Par conséquent, l’objectif de cette étude était d’évaluer et de comparer quantitativement la capacité de scellement du scellant BC et de l’AH Plus au niveau des tubules dentaires apicaux, moyens et coronaux à l’aide de SEM et de micro-TDM. L’étude a été réalisée sous l’hypothèse nulle qu’aucune différence dans la capacité de sceller les tubules dentaires ne serait observée entre les deux scellants canalaires testés.
MATÉRIEL ET MÉTHODES
Dans cette étude, des prémolaires mandibulaires humaines de taille similaire, à racine unique, extraites par des raisons orthodontiques, ont été prélevées auprès de patients de la clinique, après leur consentement verbal et informel pour l’utilisation de ces dents en laboratoire avec l’approbation éthique du Comité d’éthique de l’Université Mustafa Kemal (n ° 20012017/4919). Toutes les dents ont été décontaminées dans de l’hypochlorite de sodium à 5,25% pendant 2 heures. Ils ont ensuite été stockés dans de l’eau distillée jusqu’à des tests supplémentaires. Les dents ont été examinées à l’aide d’un microscope opératoire (Carl Zeiss Meditec AG, Oberkochen, Allemagne) à un grossissement 20 ×, et celles avec des apex immatures, des caries, des restaurations, des fractures ou des fissures ont été exclues de l’étude, et seules les dents avec des canaux ovales ont été incluses dans la procédure de normalisation de l’expérience. Des radiographies préopératoires ont été obtenues dans les directions mésiodistale et buccolingue pour confirmer la présence d’un seul canal radiculaire non manipulé sans carie radiculaire, résorption ou calcification. Au total, 24 dents ont été incluses et décorées à la jonction ciment-émail, et chaque racine a été ajustée à environ 12 mm de longueur. Par la suite, un fichier K # 10 (Dentsply Maillefer, Ballaige, Suisse) a été inséré dans le canal radiculaire jusqu’à ce que la pointe soit à l’apex. La longueur de travail a été déterminée en soustrayant 0,5 mm de cette longueur. Suisse) a été inséré dans le canal radiculaire jusqu’à ce que la pointe soit à l’apex. La longueur de travail a été déterminée en soustrayant 0,5 mm de cette longueur. Suisse) a été inséré dans le canal radiculaire jusqu’à ce que la pointe soit à l’apex. La longueur de travail a été déterminée en soustrayant 0,5 mm de cette longueur.
Tous les échantillons avaient une conicité de 0,06. En conséquence, toutes les dents ont été instrumentées à une taille de 40/06 en utilisant une technique de couronnement avec un instrument rotatif NiTi à cône EndoSequence 0,06 (Brasseler). L’irrigation a été réalisée avec 2 ml de NaOCl à 2,5% entre chaque utilisation de l’instrument. Après la manipulation des dents, un rinçage final d’une minute avec 2 ml de NaOCl à 2,5%, 2 ml d’EDTA à 17% (acide éthylènediaminetétraacétique, Patterson Dental Supply, Fort Worth, Texas, États-Unis) et 10 ml d’eau distillée a été effectué pour éliminer la couche de frottis. Les canaux ont ensuite été séchés avec des pointes en papier (Dentsply Tulsa Dental, Johnson City, Tennessee, USA), et ces échantillons ont été répartis au hasard en deux groupes (n = 12 pour chaque groupe). Après les tests micro-CT, trois dents de chaque groupe ont été sélectionnées au hasard pour l’évaluation de la couche de frottis à l’aide de SEM ( figure 1 ).
Figure 1 Images de microscopie électronique à balayage (MEB) montrant (a) des tubules de dentine ouverts après traitement à l’EDTA; (b) des tubules dentinaires partiellement obturés dans la section apicale en utilisant AH Plus; (c) des tubules dentinaires partiellement obturés dans la région apicale à l’aide du scellant EndoSequence BC; (d) une étanchéité supérieure dans la région coronale en utilisant AH Plus; et (e) une étanchéité supérieure dans la région coronale à l’aide du scellant EndoSequence BC
Les scellants pour canaux radiculaires ont été préparés selon les instructions des fabricants et insérés à l’intérieur du canal par une spirale lentulo de taille 40 (Produits Dentaires SA, Vevey, Suisse) pour répartir uniformément les scellants dans tout le canal avec la technique du cône unique. Groupe 1: les dents ont été obturées avec AH Plus Root Canal Sealer (Dentsply DeTrey, Constance, Allemagne) et 40/06 gutta-percha Dentsply Maillefer, Ballaiges, Suisse); Groupe 2: les dents ont été remplies avec EndoSequence BC Sealer (Brasseler USA, Savannah, Géorgie, USA; et 40/06 gutta-percha (Dentsply Maillefer, Ballaiges, Suisse). Après le remplissage, les racines ont été stockées à 37 ° C et 100 % d’humidité pendant 5 jours pour permettre au scellant de prendre entièrement. Le volume et l’application du scellant ont suivi les étapes décrites précédemment 11 .
Acquisition d’imagerie micro-CT
La numérisation a été effectuée à l’aide de micro-CT haute résolution Skyscan 1172 (Brüker, Kontich, Belgique) à 100 kVp, courant de faisceau de 100 mA, filtre Al / Cu de 0,5 mm, taille de pixel de 13,67 μm, rotation de 0,5 pas et durcissement du faisceau de 30%. Pour minimiser les artefacts annulaires, un étalonnage à l’air du détecteur a été effectué avant chaque balayage. Chaque échantillon a été tourné à 360 ° avec un temps d’intégration de 5 min. Des paramètres supplémentaires ont également été mis en œuvre, y compris une correction de durcissement du faisceau comme décrit précédemment, et des limites de contraste optimales (0-0,06) basées sur le balayage et la reconstruction antérieurs des dents. Pour la visualisation et la quantification d’images axiales bidimensionnelles (2D) de 1 000 × 1 000 pixels, le logiciel NRecon (ver. 1.6.7.2; Brüker, Kontich, Belgique) a été utilisé avec un algorithme décrit par Bouxsein, et al. 5(2010 Pour la reconstruction, le lissage a été initialement réglé sur zéro, suivi d’un réglage de 40% lorsque la correction d’artefact en anneau (correction de champ plat) a été appliquée. Les limites de contraste ont été définies conformément aux instructions de Skyscan.
Analyse d’imagerie micro-CT
À partir des images micro-CT reconstruites, les racines ont été divisées en sections apicales (0–4 mm), moyennes (4–8 mm) et coronales (8–12 mm). Pour les analyses de microporosité, une zone d’anneau fixe (diamètre de 2 mm) a été sélectionnée comme région d’intérêt (ROI) le long des différentes sections de dent à l’aide du logiciel CTAn (version 1.12.9, Brüker, Kontich, Belgique), qui comprenait la dentine , scellant pour canal radiculaire et guttapercha. Tous les paramètres du logiciel et les outils d’amélioration de l’agrandissement, du contraste et de l’imagerie sont restés les mêmes pour analyser les microarchitectures 3D de chaque échantillon. Une fois que le retour sur investissement approprié (en volume 3D) a été sélectionné, des images binaires ont été obtenues et un seuil de niveaux de gris approprié a été sélectionné manuellement pour distinguer la gutta-percha, le scellant canalaire et la dentine. Le décapage a été effectué pour éliminer les taches blanches dans les images 3D qui étaient inférieures à 10 voxels. Suite à cela, des analyses d’imagerie 3D ont été effectuées pour calculer la porosité du scellant dans le volume de ROI.
Évaluation en microscopie électronique à balayage
Après la micro-tomodensitométrie, trois dents de chaque groupe ont été sélectionnées au hasard pour l’analyse SEM. Les racines ont été sectionnées longitudinalement dans la direction labiolingue et divisées en sections apicales (0–5 mm) et coronales (7–12 mm). Les coupes ont été séchées sous vide, recouvertes d’or, puis examinées par SEM (Carl Zeiss NTS GmbH, Oberkochen, Allemagne). La pénétration des scellants dans les tubules dentinaires et l’adaptation de chaque scellant à la dentine ont été examinées des extrémités coronale aux apicales à un grossissement de 1500 ×, et enfin, les microphotographies ont été prises.
Analyse de microporosité 3D
Dans cette étude, le volume total de ROI (mm 3 ), le volume d’objet (volume de dentine, mm 3 ), le volume de pores fermés (mm 3 ), la surface de pores fermés (mm 2 ), le volume de pores ouverts (mm 3 ), et la porosité ouverte (%) ont été mesurées à l’aide du logiciel CTAn (version 1.12.9, Brüker, Kontich, Belgique).
Un pore ouvert a été défini comme le pore qui coupe la limite du ROI, ce qui signifie qu’un pore ouvert a été connecté à l’extérieur en 2D ou 3D. Par conséquent, les pores ouverts étaient une propriété du ROI, où le scellant pour canal radiculaire pénétrait dans les tubules dentinaires et se connectait de l’intérieur vers l’extérieur du ROI. En revanche, un pore fermé était celui sans connexion à l’extérieur en 2D ou 3D. Les pores fermés étaient considérés comme des pixels noirs entourés d’une bordure de pixels blancs. Ces pores ont été pris comme des tubules de dentine déjà remplis ou scellés. La porosité ouverte a été calculée comme le volume de pores ouverts (tel que défini ci-dessus) en pourcentage du volume total de ROI. Suite à ces calculs, le logiciel CTVol (version 2.2.3.0; Brüker, Kontich, Belgique) a été utilisé pour générer un modèle 3D de chaque échantillon et évaluer la distribution des pores ouverts et fermés. À partir des modèles 3D, le volume de dentine, le volume du canal radiculaire pénétré par le scellant et le volume total de ROI ont été calculés. Comme représenté sur la Figure 2 , chaque segmentation a reçu des couleurs différentes à l’aide du logiciel CTVol.
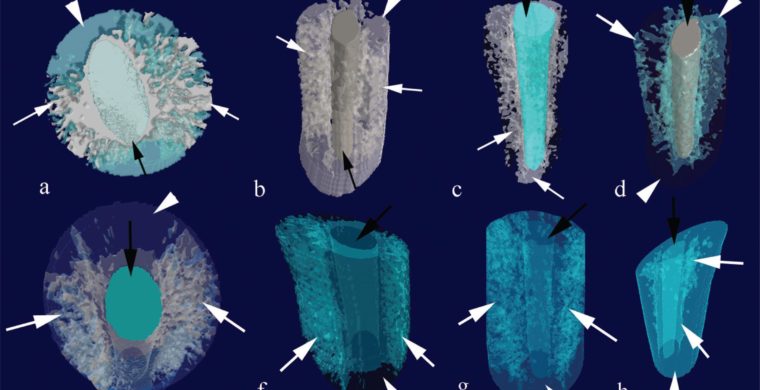
 Figure 2 Images de tomodensitométrie (micro-CT) montrant une représentation tridimensionnelle (3D) d’AH Plus (a) et du scellant EndoSequence BC (e) dans les coupes coronales à partir d’une vue axiale. La pénétration supérieure a pu être observée dans les coupes coronale (b-AH Plus, f-BC), moyenne (c-AH Plus, g-BC) et apicale (d-AH Plus, h-BC sealer). Les flèches blanches indiquent les obturateurs canalaires; les flèches noires indiquent la gutta-percha; et les pointes de flèches indiquent la dentine
Figure 2 Images de tomodensitométrie (micro-CT) montrant une représentation tridimensionnelle (3D) d’AH Plus (a) et du scellant EndoSequence BC (e) dans les coupes coronales à partir d’une vue axiale. La pénétration supérieure a pu être observée dans les coupes coronale (b-AH Plus, f-BC), moyenne (c-AH Plus, g-BC) et apicale (d-AH Plus, h-BC sealer). Les flèches blanches indiquent les obturateurs canalaires; les flèches noires indiquent la gutta-percha; et les pointes de flèches indiquent la dentine
analyses statistiques
Les différences entre les deux groupes ont été évaluées à l’aide des deux tests t sur échantillon indépendant et du test U de Mann-Whitney alors que la normalité n’était pas respectée. Un logiciel statistique SPSS (ver. 20.0, Chicago, IL) a été utilisé pour toutes les analyses, et les valeurs de p <0,05 ont été considérées comme statistiquement significatives.
RÉSULTATS
Les analyses MEB des canaux radiculaires obturés avec des scellants canalaires testés ont révélé que leur adaptation à la dentine était suffisante sur toute la longueur du canal radiculaire. Par rapport à la section apicale, les sections coronales ont montré une étanchéité supérieure où la texture des scellants dans les tubules était homogène ( figure 1 ).
Les tests micro-CT ont montré une vue d’ensemble claire de la dentine dentaire, des matériaux de scellement et de la gutta-percha aux valeurs de gris attribuées. Les micropores à l’interface ont pu être observés entre la dentine du canal radiculaire et le scellant de remplissage dans tous les groupes testés. Les paramètres structurels 3D des micropores dans tout le système radiculaire à l’aide de micro-CT ont été résumés dans le tableau 1. Le volume des pores fermés était plus important pour le scellant AH Plus dans la section apicale que pour le scellant EndoSequence BC, mais sans signification statistique. Le volume des pores fermés et la surface des pores fermés ont montré les valeurs les plus élevées dans les coupes coronales, suivies des coupes médiane et apicale pour les deux mastics (p <0,05). Cependant, aucune différence significative n’a été observée pour le volume des pores fermés et la surface des pores fermés entre les scellants AH Plus et BC dans les trois sections (p> 0,05), alors qu’ils étaient plus grands dans la section apicale lorsque le scellant AH Plus a été utilisé. .
Tableau 1 Paramètres structurels tridimensionnels (3D) des micropores dans tout le système canalaire étudié par micro-CT
| Sections | Groupes | Nombre d’échantillons (N) | Volume ROI total (mm3) | Objet (dentine) Volume (mm 3 ) | Volume des pores fermés (mm 3 ) | Surface des pores fermés (mm 2 ) | Volume des pores ouverts (mm 3 ) | Porosité ouverte (%) |
|---|---|---|---|---|---|---|---|---|
| Troisième apical | Scellant AH Plus | 12 | 7.177 | 1.500 | 0,151 a | 0,231 a | 4,49 a | 64,24 a |
| BC Sealer | 12 | 7.400 | 1,420 | 0,115 a | 0,189 a | 6,24 c | 73,86 a | |
| Tiers moyen | Scellant AH Plus | 12 | 7.235 | 1,445 | 0,354 b | 0,322 b | 6,10 b, c | 70,24 a |
| BC Sealer | 12 | 7,960 | 1,330 | 0,408 b | 0,431 b | 6,84 d | 83,25 a, b | |
| Troisième coronal | Scellant AH Plus | 12 | 7.383 | 1,358 | 0,620 c | 0,636 c | 6,32 b, c | 75,39 a, b |
| BC Sealer | 12 | 7,962 | 1,330 | 0,861 c | 0.763 c | 6,72 d | 82,74 b |
Comme le montre la figure 2 ,le scellant BC avait un plus grand volume de pores ouverts que le AH Plus (p <0,05), quelle que soit la section des dents. Le volume des pores ouverts était également plus important dans la section coronale par rapport à la section apicale pour les deux produits d’étanchéité (p <0,05). De même, la porosité ouverte était également plus grande dans la section coronale par rapport à la section apicale pour les deux chasseurs, bien que la signification n’existait que pour le chasseur BC (p <0,05); cependant, aucune différence significative n’a été observée entre les sections coronale et moyenne (p> 0,05).
DISCUSSION
Le scellement hermétique est le principal facteur associé au succès du traitement du canal radiculaire, et Ingle et al. 4 (2008) ont souligné que 58% des échecs de traitement étaient dus à une obturation incomplète. Ainsi, la décontamination et l’obturation 3D sont essentielles après les traitements canalaires 21 . Pour cette raison, les matériaux d’obturation canalaire s’améliorent continuellement et les matériaux bioactifs deviennent de plus en plus populaires. Le scellant EndoSequence BC est l’un des scellants bioactifs idéaux qui contient des nanoparticules (environ 2 μm de diamètre) facilitant la pénétration dans les tubules dentinaires 1 . Des études antérieures ont suggéré que AH Plus peut être considéré comme l’étalon-or pour les produits d’étanchéité des canaux radiculaires; par conséquent, nous avons comparé ce scellant au scellant bioactif EndoSequence BC3 .
La qualité de l’obturation peut être influencée par la morphologie du canal radiculaire (rond ou ovale) 24 . Pour cette raison, nous n’avons sélectionné que le canal ovale qui a facilité le fonctionnement du microscope. La solution finale d’irrigation de 17% d’EDTA a été appliquée pendant 1 min pour ouvrir efficacement les tubules dentinaires. La faible tension superficielle de l’EDTA facilite également son accès dans les tubules dentinaires pour éliminer la couche de frottis 29 , ce qui améliore l’accès et l’adaptation des mastics à la dentine 7 . Cependant, il convient de noter qu’en raison de l’application d’EDTA, la porosité ouverte dans tout le système canalaire – en particulier dans la section coronale – pourrait être augmentée en supprimant les couches de frottis.
Les analyses de microporosité ont révélé que le volume des pores fermés et la surface des pores fermés avaient les valeurs les plus élevées dans les sections coronales et les plus petites dans les sections apicales pour les deux produits d’étanchéité dans tous les niveaux du canal radiculaire. Cela a également été confirmé par notre observation SEM. Ces résultats concordaient avec une autre étude d’adaptation marginale 23, qui a également montré que les sections coronales avaient une adaptation supérieure par rapport aux sections apicales. De l’autre côté, le volume des pores ouverts du scellant BC était significativement plus grand que le scellant AH Plus, tandis que pour la porosité ouverte, les différences entre deux scellants ont disparu, ce qui suggère que le scellant BC peut avoir plus de pénétration dans les tubules dentinaires. Cela peut être dû à la petite taille des particules du scellant EndoSequence BC (environ 2 μm de diamètre) ou à la viscosité des matériaux à base de silicate de phosphate de calcium qui facilitent l’écoulement du scellant dans les tubules dentinaires.
Les matériaux biocéramiques contiennent de l’alumine, de la zircone, du verre bioactif, de la vitrocéramique, de l’hydroxyapatite et des phosphates de calcium 17 . Il a été signalé que la nature alcaline des sous-produits biocéramiques dénature les fibres de collagène, ce qui facilite la pénétration des scellants dans les tubules dentinaires 2 . Cependant, AH Plus est naturellement acide, ce qui peut limiter sa liaison à la dentine. De plus, AH Plus contient un polymère qui se contracte lors de la polymérisation, ce qui peut entraîner une fissuration et une détérioration du scellant. Ainsi, il est probable pour ces raisons que le scellant EndoSequence BC présente une capacité de scellage supérieure à AH Plus, mais n’a pas encore été confirmé par d’autres études de suivi in vivo.
Dans la présente étude, un volume similaire de pores fermés a été observé entre le scellant EndoSequence BC et le AH Plus, ce qui indique que les scellants testés s’adaptent ou pénètrent également dans la dentine dans les sections coronale, moyenne et apicale. De même, en utilisant une méthode de filtration des fluides et SEM, Zhang, et al. 30(2009) ont étudié la capacité d’étanchéité du scellant iRoot SP et du scellant AH Plus à la section apicale des racines des dents. Il a été constaté que l’iRoot SP utilisant la technique à cône unique et l’AH Plus utilisant la technique de condensation à ondes continues étaient équivalents en termes de fuite de fluide. SEM a également révélé que les deux scellants fournissaient des régions sans espace et contenant des espaces dans les canaux. Conformément à ces résultats, l’observation SEM dans cette étude a montré que l’adaptation apicale des enduits EndoSequence BC et AH Plus était également similaire. Cependant, Al-Haddad et al. 1(2015) ont rapporté que le scellant EndoSequence BC était significativement plus épais que le AH Plus ou le MTA Fillapex (agrégats de trioxyde minéral) en utilisant la technique de compactage latéral, ce qui a amélioré la capacité de scellage. La raison possible de cet écart pourrait être dérivée des différentes techniques d’obturation et que les résultats de cette étude étaient basés sur la technique à cône unique, qui s’est avérée être un moyen efficace d’obtenir des canaux radiculaires bien effilés après une instrumentation rotative adéquate 18 .
Le degré d’adhésion du scellant à la paroi de la dentine dépend en grande partie de l’énergie de surface intermoléculaire et de la propreté de la dentine, ainsi que de la tension de surface et de la capacité de mouillage du scellant. La dentine aux sections coronale, moyenne et apicale a des énergies de surface et une propreté différentes. La propreté est un facteur important pour l’adaptation du scellant, qui pourrait être difficile à réaliser dans la région apicale en raison des difficultés à retirer la couche de maculage. La couche de frottis bloque souvent l’entrée du scellant dans les tubules dentinaires, et il a été suggéré que les différences entre les régions apicales et coronales pourraient être dues à la densité et au diamètre inférieurs des tubules dentinaires dans les régions apicales 10. Cette suggestion peut également expliquer l’augmentation de la porosité des régions coronale et moyenne – représentée par le volume des pores ouverts – par rapport à celles observées dans la région apicale dans notre étude.
La micro-CT haute résolution est une méthode d’imagerie non destructive et très précise qui est de plus en plus utilisée pour l’évaluation non invasive des microstructures 3D. En plus de mesurer le volume, la micro-TDM facilite les analyses qualitatives des images et différencie les matériaux d’obturation, les vides et les structures dentaires, sur la base de l’imagerie en niveaux de gris 8 , 15 . De plus, on constate que les matériaux d’obturation des racines et la résolution de voxel appliquée pendant le scan peuvent influencer la présence d’artefacts et donc les résultats observés 6 . Ainsi, il est préférable d’appliquer une taille de voxel et un FOV plus petits pour minimiser la présence d’artefacts et améliorer la précision du diagnostic ou de l’évaluation dans les dents remplies de racines. Comme l’a souligné une autre étude 22, une résolution de 34 et 68 μm serait suffisante pour les études de micro-TDM endodontique en respectant l’anatomie radiculaire. La résolution de la micro-CT utilisée dans la présente étude est aussi élevée que la taille de voxel de 13,67 μm et la segmentation d’imagerie en niveaux de gris, permettant de différencier une structure de porosité claire et d’évaluer davantage leurs dimensions dans la région du scellant.
Jusqu’à présent, aucun des travaux antérieurs sur le scellant pour racines ne s’est concentré sur la caractérisation de la porosité ouverte ou fermée. Cette étude montre la capacité de la micro-TDM à observer la taille, la surface et l’emplacement des pores ouverts et fermés à l’interface entre la dentine et les mastics en 3D. Cependant, tout en évaluant les images micro-CT de cas endodontiques, il est nécessaire de considérer les effets de durcissement du faisceau. En raison de la polychromaticité de la source de rayons X, cet artefact d’imagerie peut provoquer des distorsions visuelles des objets reconstruits, telles qu’une amélioration des bords des matériaux d’obturation des racines. Pour compenser ces artefacts, une correction de durcissement du faisceau a été effectuée lors de la reconstruction de l’imagerie, ce qui conduit inévitablement à une diminution de la qualité de l’image à un certain niveau. En outre, il faut être conscient de la limitation de la taille des voxels de la micro-TDM en raison de son incapacité à analyser la couche de frottis résultante et les débris retenus dans les tubules dentinaires; SEM peut être utilisé pour expatier la morphologie de surface des canaux radiculaires, permettant la confirmation des matériaux de remplissage présentés sur la paroi du canal radiculaire. Ainsi, la combinaison d’analyses SEM et micro-CT peut être une approche puissante pour les études évaluant la capacité de scellement14 .
En résumé, dans les limites de l’étude, l’hypothèse nulle selon laquelle aucune différence ne serait observée entre les capacités d’EndoSequence et d’AH Plus pour sceller les tubules dentinaires est acceptée lors de l’utilisation de la technique à cône unique, ce qui suggère que le scellant EndoSequence BC a une étanchéité similaire capacité dans tout le canal radiculaire comme le fait le scellant AH Plus. Un meilleur effet d’étanchéité pourrait être obtenu dans les sections coronales et moyennes que la partie apicale en utilisant l’un de ces ciments de scellement testés.
Source :
HUANG Yan, ORHAN Kaan, CELIKTEN Berkan, ORHAN Ayşe Işıl, TUFENKCI Pelin, SEVIMAY Semra. Evaluation of the sealing ability of different root canal sealers: a combined SEM and micro-CT study. J. Appl. Oral Sci. [Internet]. 2018 [cited 2020 Feb 12] ; 26: e20160584. Available from: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1678-77572018000100402&lng=en. Epub Jan 15, 2018. http://dx.doi.org/10.1590/1678-7757-2016-0584.
RÉFÉRENCES
1- Al-Haddad A, Abou Kasim NH, Che Ab Aziz ZA. Adaptation interfaciale et épaisseur des scellants canalaires à base de biocéramique. Dent Mater J. 2015; 34 (4): 516-21.
2- Balguerie E, van der Sluis L, Vallaeys K, Gurgel-Georgelin M, Diemer F.Pénétration et adaptation du scellant dans les tubules dentinaires: une étude au microscope électronique à balayage. J Endod. 2011; 37 (11): 1576-9.
3- Barrieshi KM, Walton RE, Johnson WT, Drake DR. Fuite coronale de bactéries anaérobies mixtes après obturation et préparation post-espace. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1997; 84 (3): 310-4.
4- Benenati FW. Obturation de l’espace radiculaire. Dans: Ingle JI, Bakland LK, Baumgartner JC, éditeurs. Endodontie d’Ingle. 6 éd. Hamilton: BC Decker; 2008. p.1053-87.
5- Bouxsein ML, Boyd SK, Christiansen BA, Guldberg RE, Jepsen KJ, Müller R. Lignes directrices pour l’évaluation de la microstructure osseuse chez les rongeurs à l’aide de la tomodensitométrie. J Bone Miner Res. 2010; 25 (7): 1468-86.
6- Brito-Júnior M, Santos LA, Faria-e-Silva AL, Pereira RD, Sousa-Neto MD. Évaluation ex vivo d’artefacts imitant les lignes de fracture sur la tomodensitométrie à faisceau conique produite par différents scelleurs de canal radiculaire. Int Endod J. 2014; 47 (1): 26-31.
7- Çalt S, Serper A. Effets dépendants du temps de l’EDTA sur les structures dentinaires. J Endod. 2002; 28 (1): 17-9.
8- Celikten B, Uzuntas CF, Orhan AI, Tufenkci P, Misirli M, Demiralp KO, et al. Évaluation par micro-tomodensitométrie de l’étanchéité de trois techniques d’obturation canalaire. J Oral Sci. 2015; 57 (4): 361-6.
9- Ersahan S, Aydin C. Résistance à la luxation d’iRoot SP, un scellant à base de silicate de calcium, provenant de la dentine radiculaire. J Endod. 2010; 36 (12): 2000-2.
10- Ferrari M, Mannocci F, Vichi A, Cagidiaco MC, Mjör IA. Collage au canal radiculaire: caractéristiques structurales du substrat. Suis J Dent. 2000; 13 (5): 255-60.
11- Gandolfi M, Parrilli A, Fini M, Prati C, Dummer PM. Analyse micro □ CT 3D des vides d’interface associés aux obturations de racines Thermafil utilisées avec AH Plus ou un scellant MTA fluide. Int Endod J.2013; 46 (3): 253-63.
12- Gomes-Filho JE, Moreira JV, Watanabe S, Lodi CS, Cintra LT, Dezan Junior E, et al. Scellabilité des scellants contenant du MTA et de l’hydroxyde de calcium. J Appl Oral Sci. 2012; 20 (3): 347-51.
13- Hammad M, Qualtrough A, Silikas N. Évaluation de l’obturation canalaire: une étude tridimensionnelle in vitro . J Endod. 2009; 35 (4): 541-4.
14- Hülsmann M, Bluhm V. Efficacité, capacité de nettoyage et sécurité de différents instruments rotatifs NiTi dans le retraitement du canal radiculaire. Int Endod J. 2004; 37 (7): 468-76.
15- Jung M, Lommel D, Klimek J. L’imagerie de l’obturation canalaire par micro-TDM. Int Endod J. 2005; 38 (9): 617-26.
16- Khayat A, Lee SJ, Torabinejad M. Pénétration humaine de la salive des canaux radiculaires obturés non scellés. J Endod. 1993; 19 (9): 458-61.
17- Koch K, Brave D. Bioceramics, part I: le point de vue du clinicien. Dent aujourd’hui. 2012; 31 (1): 130-5.
18- Krug R, Krastl G, Jahreis M. Qualité technique d’une technique de remplissage à cône unique à cône assorti après instrumentation rotative par rapport au compactage latéral après préparation manuelle: une étude rétrospective. Clin Oral Investig. 2017; 21 (2): 643-52.
19- Oliver C, Abbott P. Corrélation entre le succès clinique et la pénétration du colorant apical. Int Endod J. 2001; 34 (8): 637-44.
20- Patel D, Sherriff M, Ford T, Watson T, Mannocci F.La pénétration de l’amorce RealSeal et de Tubliseal dans les tubules dentinaires du canal radiculaire: une étude microscopique confocale. Int Endod J. 2007; 40 (1): 67-71.
21- Pawar SS, Pujar MA, Makandar SD. Évaluation de la capacité de scellement apical du scellant biocéramique, AH Plus et Epiphany: une étude in vitro . J Conserv Dent. 2014; 17 (6): 579-82.
22- Peters OA, Laib A, Rüegsegger P, Barbakow F. Analyse tridimensionnelle de la géométrie du canal radiculaire par tomodensitométrie à haute résolution. J Dent Res. 2000; 79 (6): 1405-9.
23- Polineni S, Bolla N, Mandava P, Vemuri S, Mallela M, Gandham VM. Adaptation marginale des nouveaux scellants canalaires à la dentine: une étude SEM. J Conserv Dent. 2016; 19 (4): 360-3.
24- Robberecht L, Colard T, Claisse-Crinquette A. Évaluation qualitative de deux techniques d’obturation endodontique: méthode conique à cône unique versus condensation verticale chaude et système d’injection une étude in vitro . J Oral Sci. 2012; 54 (1): 99-104.
25- Sevimay S, Kalayci A. Évaluation de la capacité de scellement apical et adaptation à la dentine de deux scellants à base de résine. J Réhabilitation orale. 2005; 32 (2): 105-10.
26- Trope M, Chow E, Nissan R. Pénétration endotoxinique in vitro de dents traitées par endodontie non scellées. Endod Dent Traumatol. 1995; 11 (2): 90-4.
27- Tsesis I, Goldberger T, Taschieri S, Seifan M, Tamse A, Rosen E. La dynamique des lésions périapicales dans les dents traitées endodontiquement sans intervention: une étude longitudinale. J Endod. 2013; 39 (12): 1510-5.
28- Wolanek GA, Loushine RJ, Weller RN, Kimbrough WF, Volkmann KR. Pénétration bactérienne in vitro de dents traitées par endodontie scellées coronairement avec un agent de liaison dentinaire. J Endod. 2001; 27 (5): 354-7.
29- Yilmaz Z, Basbag B, Buzoglu HD, Gümüsderelioglu M. Effet des solutions EDTA à faible tension superficielle sur la mouillabilité de la dentine canalaire. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2011; 111 (1): 109-14.
30- Zhang W, Li Z, Peng B. Évaluation de la capacité de scellage apical d’un nouveau scelleur de canal radiculaire. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2009; 107 (6): e79-82.